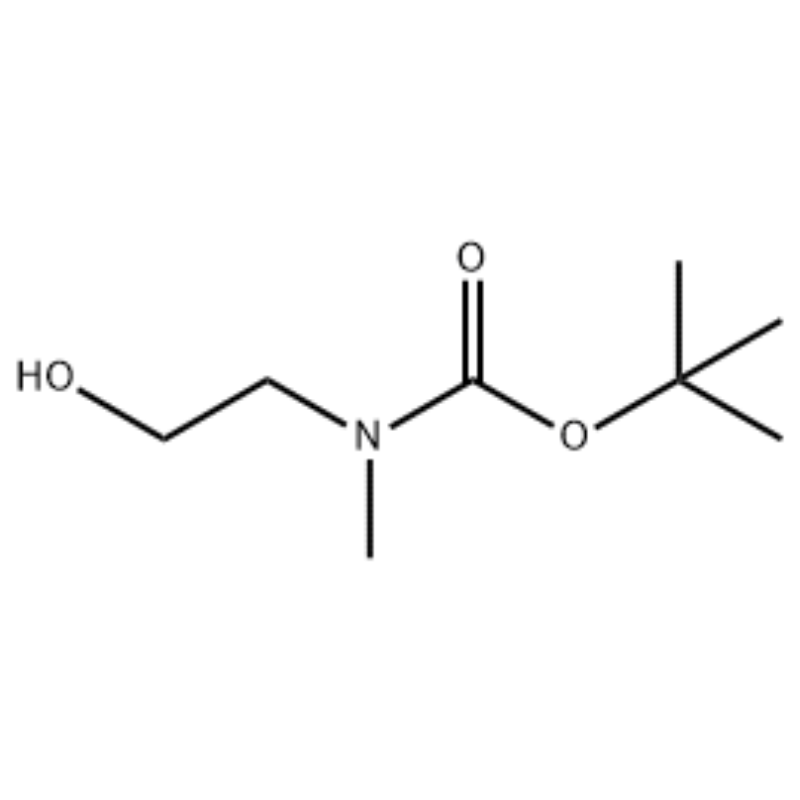
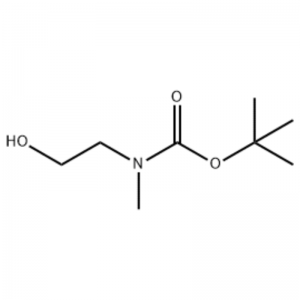
Till en lösning av 2-(metylamino)etanol (500 mg, 0,53 ml, 6,66 mmol) i CH2Cl2 (20 ml) sattes Boc2O (1,48 g, 6,79 mmol), följt av omrörning vid rumstemperatur i 1 timme.Reaktionslösningen extraherades med saltlösning och CH2CI2.Det så erhållna organiska skiktet torkades över MgS04 och filtrerades.Därefter koncentrerades filtratet i vakuum för att erhålla den avsedda föreningen (färglös olja, kvantitativ);'H NMR (200 MHz, CDCI3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);masspektrum m/e (relativ intensitet) 144 (20) 102 (24) 57 (70) 44 (100).
Exempel 38;N1-(3-fluor-4-(2-(1-(2-(metylamino)etyl)-1H-imidazol-4-yl)tieno[3,2-b]pyridin-7-yloxi)fenyl)-N3 -(2-metoxifenyl)malonamid (96);Steg 1: tert-butyl-2-hydroxietyl(metyl)karbamat (97) (J. Med. Chem., 1999, 42, 11, 2008) Till en lösning av 2-(metylamino)etanol (5,0 g, 67 mmol) i THF (50 ml) vid RT tillsattes Boc2O (15,7 g, 72 mmol) och reaktionsblandningen omrördes vid RT i 4 timmar.Reaktionsblandningen koncentrerades till torrhet och titelföreningen 97 användes direkt i nästa steg utan ytterligare rening (11,74 g, 100 % utbyte).MS (m/z): 176,2 (M+H).
Framställning av l-2-[4-brom-2-(4-oxo-2-ftiotaioxo1hiazolidin-5-ylidenmefliyl)fenoxi]efliyl-3-efliyl-l-metylurea(Compoiotamd 161) Steg 1: Syntes av t-butyl2- hydroxietylmetylkarbamat;Till en lösning av 2-(metylamino)etanol (500 mg, 0,53 ml, 6,66 mmol) i CH2Cl2 (20 ml) sattes BoC2O (1,48 g, 6,79 mmol), följt av omrörning vid rumstemperatur i 1 timme.Reaktionslösningen extraherades med saltlösning och CH2CI2.Det så erhållna organiska skiktet torkades över MgS04 och filtrerades.Därefter koncentrerades filtratet i vakuum för att erhålla den avsedda föreningen (färglös olja, kvantitativ); 'HNMR (200 MHz, CDCI3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);masspektrum m/e (relativ intensitet) 144 (20) 102 (24) 57 (70) 44 (100).
2-(metylamino)etanol (90,1 g, 1,2 mol) löstes i 1,2 L metylenklorid och BoC2O (218 g, 1 mol) tillsattes långsamt under omrörning vid 0°C, följt av vid rumstemperatur i 3 timmar.Reaktionsblandningen tvättades i tur och ordning med 700 ml av en vattenlösning av mättad ammoniumklorid och 300 ml vatten.Den tvättade blandningen dehydratiserades med användning av vattenfritt natriumsulfat och koncentrerades under reducerat tryck för att erhålla föreningen (a) (175 g, 1 mol, 100%) som en olja utan färg. TLC: Rf = 0,5 (50% EtOAc i Hex) visualiserad med Ce-Mo-färgning IH NMR (600 MHz, CDCI3) delta 1,47 (s, 9H), 2,88 (br s, IH), 3,41 (br s, 2H), 3,76 (br s, 2H).
90,1 g (1,2 mol) 2-(metylamino)etanol löstes i 1,2 L metylenklorid, 218 g (1 mol) Boc2O tillsattes långsamt medan den resulterande lösningen omrördes vid 0C, och den resulterande lösningen omrördes vid rumstemperatur i 3 timmar.Reaktionsblandningen tvättades i tur och ordning med 700 ml av en vattenhaltig mättad ammoniumkloridlösning och 300 ml vatten, dehydrerades med vattenfritt natriumsulfat och koncentrerades sedan under reducerat tryck för att erhålla 175 g (1 mol) av en akromatisk oljeförening skyddad av Boc-grupp (utbyte: 100%).1H NMR (600 MHz, CDCI3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H) [0141] 90 g (0,514 mol) av den erhållna föreningen löstes i 1,5 L tetrahydrofuran, 88,0 g (539 mol) N- hydroxiftalimid och 141 g (0,539 mol) trifenylfosfin tillsattes, 106 ml (0,539 mol) diisopropylazodikarboxylat tillsattes långsamt under omrörning av den resulterande lösningen vid 0°C, och den resulterande lösningen omrördes i 3 timmar medan dess temperatur höjdes. till rumstemperatur.Efter koncentrering av reaktionsblandningen under reducerat tryck sattes 600 ml isopropyleter därtill, den resulterande lösningen omrördes vid 0°C under 1 timme och vit fast typ av trifenylfosfinoxid filtrerades.Den fasta substansen tvättades med 200 ml isopropyleter kyld till 0°C och uppsamlades med det första filtratet, och det resulterande filtratet koncentrerades under reducerat tryck för att erhålla 198 g av en blandning av förening XX och diisopropylhydrazodikarboxylat i ett blandningsförhållande av 10 till 15 %. (utbyte: 120%).1H NMR (600MHz, CDCI3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d J = 15,0 Hz, 3H), 1,46 (d, J=16,2 Hz, 9H)
 Byggnad 12, No.309, South 2nd Road, Economic Development Zone, Longquanyi District, Chengdu, Sichuan, Kina.
Byggnad 12, No.309, South 2nd Road, Economic Development Zone, Longquanyi District, Chengdu, Sichuan, Kina. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404



















.png)


